1. Jika tetapan kesetimbangan untuk reaksi 2A + 2 B 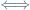 4C adalah 0,04 maka tetapan untuk kesetimbangan reaksi 2C
4C adalah 0,04 maka tetapan untuk kesetimbangan reaksi 2C 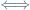 A + B adalah
A + B adalah
K1 = 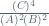 = 0,04
= 0,04
 = 0,2
= 0,2
K= 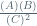 =
= 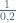 = 5
= 5
memakaiJurus Cepat:
Reaksi di balik kemudian dikalikan  maka
maka
K=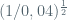
= 
= 5
2. Elektron dengan bilangan kuantum yang tidak di ijinkan adalah…….
A. n=3; l=0; m=0; s= – 
B. n=3; l=1; m=0; s= -
C. n=3; l=2; m=-1; s=+
D. n=3; l=1; m=2; s= – 
E. n=3; l=2; m=2; s= + 
Penyelesaian:
Jurus Cepat = -L 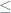 Magnetik
Magnetik  L
L
Yang tidak di ijinkan
n=3; l=1; m=2; s= –  (D)
(D)
3. Deret bilangan kuantum yang mungkin bagi elektron 3p adalah …..
A. n=3; l=3; m=+1; s= +
B. n=3; l=2; m= -1; s=+
C. n=3; l=2; m=-1; s=+
D. n=2; l=1; m=+1; s=+
E. n=3; l=1; m=+1; s=+
Penyelesaian:
Jurus Cepat:
3p : n=3, l= 1, m=+1, s= +
4. 10 ml larutan HCl mempunyai PH = 2 , larutan tersebut diencerkan dengan menambahkan air sampai volumenya 1 L, Ph larutan HCL sekarang adalah
Penyelesaian:
PH = 2 –> [HCl] = 10-2
M1.V1 = M2 . V2
0,01 . 10 = M2 . 1000
M2 = 10-4
[H+]= 1.10-4
PH = – log [H+]
= – log 10-4
= 4
Jurus Super Cepat:
PH baru = PH lama + log n
= 2 + log 1000/10
= 2 + 2
= 4
5. Bila 0,1 gram NaOH dilarutkan menjadi 250 ml maka PH dari larutan adalah……(Mr NaOH = 40)
Penyelesaian:
[NaOH] =  = 0,01M
= 0,01M [OH-] = 1 . 0,01 = 10-2
pOH = – log[OH-] = – log10-2 = 2
PH = 14 – POH = 12
6. Jika kelarutan kelarutan CaF2 dalam air sama dengan mol/L maka nilai Ksp bagi garam ini adalah
Penyelesaian:

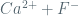 s s 2s
Ksp = (Ca2+)(F-)2
= s . (2s)2 = 4s3
Jurus super Cepat:
Ksp = XX . YY. (S)X+Y
= 11 . 22 . (S)1+2 = 4s3
s s 2s
Ksp = (Ca2+)(F-)2
= s . (2s)2 = 4s3
Jurus super Cepat:
Ksp = XX . YY. (S)X+Y
= 11 . 22 . (S)1+2 = 4s3
7. Bila diketahui Ksp Ag2CrO4 = 4.10-12 maka konsentrasi CrO4 dalam larutan jenuh AgCrO4 adalah
Penyelesaian:

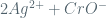 S 2s s
S 2s s
Ksp = (Ag+)2(CrO4-2)
4.10-12 = (2s)2(s)
4.10-12 = 4s3
10-12 = s3
S = 10-4(CrO4-2) = s=10-4
Jurus super Cepat:
(S) =
![\sqrt[x+y]{\frac{Ksp}{X^x . Y^y}} \sqrt[x+y]{\frac{Ksp}{X^x . Y^y}}](http://s0.wp.com/latex.php?latex=%5Csqrt%5Bx%2By%5D%7B%5Cfrac%7BKsp%7D%7BX%5Ex+.+Y%5Ey%7D%7D&bg=ffffff&fg=4b5d67&s=0)
(S) =
![\sqrt[2+1]{\frac{4 . 10^{-12}}{2^2 . 1^1}} \sqrt[2+1]{\frac{4 . 10^{-12}}{2^2 . 1^1}}](http://s0.wp.com/latex.php?latex=%5Csqrt%5B2%2B1%5D%7B%5Cfrac%7B4+.+10%5E%7B-12%7D%7D%7B2%5E2+.+1%5E1%7D%7D&bg=ffffff&fg=4b5d67&s=0)
=
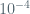
8. 1 mol logam L bereaksi dengan H2SO4 menghasilkan 33,6 L gas H2 (STP) . Rumus garam yang terbentuk adalah
Penyelesaian:
mol H2 =  =
=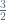 mol
mol mol H2SO4 = mol H2 = 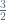 mol
mol reaksi :
Mol L : mol H2SO4 = 1 : 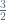 = 2 : 3
= 2 : 3 Reaksi menjadi
2 L + 3H2SO4  L2(SO4)3 + 3 H2
L2(SO4)3 + 3 H2 Jurus Super CEPAT:
Mol L . Val L = 2. mol H2
1 . Val L = 2. 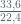
Val L = 3
9. Jika 38 gram MgSO4.XH2O dipanaskan menghasilkan 20 gram garam anhidrat Mr MgSO4 = 120 dan Mr H2O =18 harga X diatas adalah
Penyelesaian:
MgSO4.XH2O  MgSO4 + X H2O
MgSO4 + X H2O MgSO4.XH20 = 38 gram
MgSO4 = 20 gram
__________________ _
xH2O = 18 gram
Mol MgSO4 = 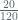 =
=  mol
mol Mol H2O = 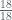
= 1 mol
Perbandingan koefisien reaksi =perbandingan mol yang bereaksi
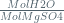 =
= 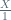
 =
= 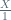

X =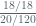
X = 6
4C adalah 0,04 maka tetapan untuk kesetimbangan reaksi 2C
A + B adalah
= 0,04
= 0,2
=
= 5
maka
Magnetik
L
(D)






0 komentar:
Posting Komentar